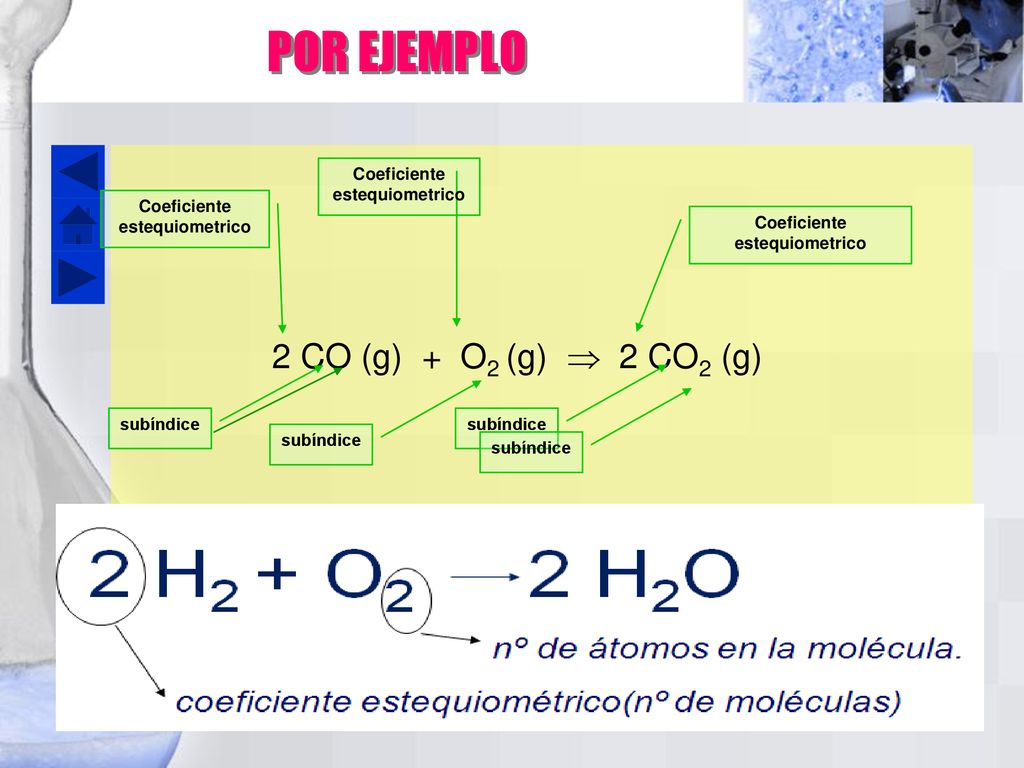
Coeficientes Estequiométricos Ejemplos
Te defino y muestro ejemplos con ejercicios resueltos sobre los coeficientes estequiométricos subíndices internos y externos de un compuesto químico.
Coeficientes estequiométricos ejemplos. Este articulo se basa en el articulo coeficiente estequiométrico publicado en la enciclopedia libre de wikipedia el contenido está disponible bajo los términos de la licencia de gnu free documentation license véase también en wikipedia para obtener una lista de autores. Tricloruro de hierro fecl3 3 y como vemos el número de átomos de cloro no es el mismo en ambas ecuaciones. En el caso siguiente se puede observar la relación entre los reactantes y el producto. Por ejemplo el agua pura es la misma sin importar cuál sea su fuente o de qué continente o planeta provenga.
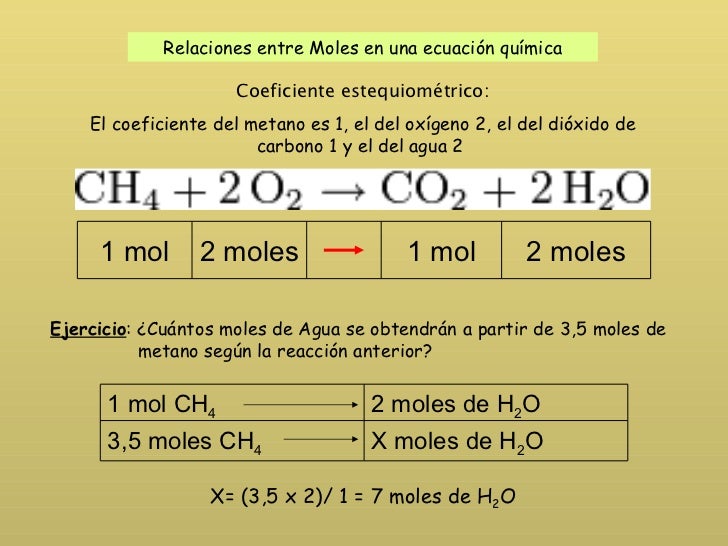
Ejemplo de coeficientes estequiometricos 1. Estequiometría de la reacción química con ejemplos por ejemplo. La masa molar de c 2 h 6 2 12 6 1 30 g mol nc 2 h 6 90 30 3 moles cuando los compuestos que incluyen átomos. El coeficiente del metano es 1 el del oxígeno 2 el del dióxido de carbono 1 y el del agua 2.
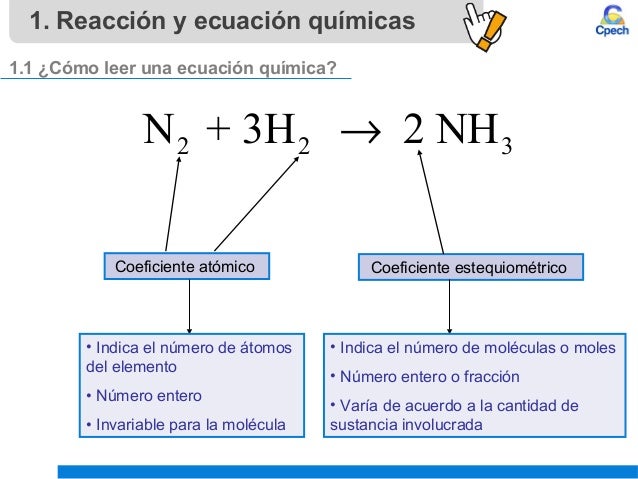
Es un número que se pone delante de cada especie química e indica la proporción en que esta especie se involucra en la reacción cuando este numero es igual a 1 no se coloca ningún numero. Si 90 g de c 2 h 6 se queman con suficiente o 2 encontrar la cantidad de moles de h 2 o co 2 son producidas y el volumen de o 2 h 1 c 12 o 16. Los coeficientes estequiométricos son en principio números enteros aunque para ajustar ciertas reacciones alguna vez se emplean números fraccionarios. Hierro fe y cloro cl 2 y su producto.
Son los subíndices que se ubican al lado derecho de un átomo o un ion e indican la cantidad de átomos o iones que tiene la especie. Un experto que en un laboratorio se encarga de generar un producto a partir de la combinación de dos o más sustancias por ejemplo necesita llevar a cabo cálculos estequiométricos para averiguar entre otros datos qué cantidad. Para cumplir el principio estequiométrico tenemos que encontrar el número total de átomos que intervienen en la reacción y el producto de modo que sean los mismos. En primer lugar encontrar moles de c 2 h 6.
4 5 4 coeficientes estequiométricos son los números que aparecen delante de las fórmulas de los reactivos y productos después de igualar la ecuación química. La tercera etapa es mediante el uso de los pesos atómicos de los elementos y los coeficientes estequiométricos obtener la proporción de las masas de los elementos reaccionantes. En este marco son fundamentales los coeficientes y los subíndices numéricos que conforman las fórmulas.